

1.机构办公室联系方式:
电子邮箱:yns2yygcp@sina.com(推荐)
电话:(0871)-65156650-2589。
2.本中心临床试验立项及启动流程
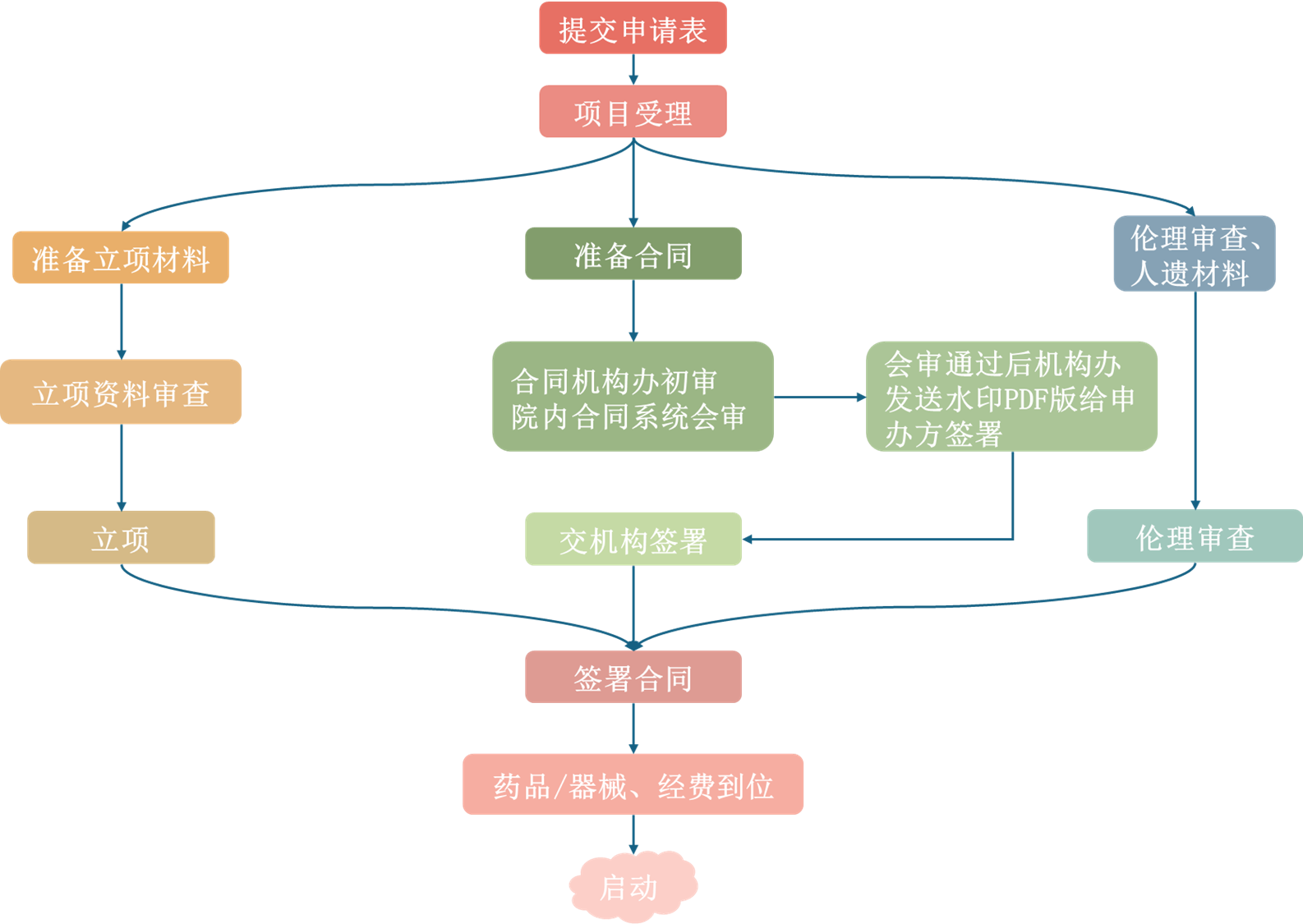
3.项目受理:至少提交临床试验申请表即可受理,机构办公室受理后向申办方发出纸质《受理通知》,持《受理通知》可向伦理办公室提交伦理审查材料。建议在提交临床试验申请表后,尽快补齐其他立项材料,以免耽误项目启动。
4.申请药物临床试验需要提交的资料(见下表)
序号 | 资料名称 | II期、III期及以注册为目的的IV期药物临床试验要求提供 | 非以注册为目的的IV期药物临床试验要求提供 | 备注 |
1 | 临床试验申请表FJ-SOP-002-06 | √ | √ | |
2 | 研究者手册(注明版本号和日期) | √ | 可以用上市药品说明书代替 | |
3 | 试验方案(注明版本号和日期,申办方盖章、本中心研究者签名) | √ | √ | |
4 | 知情同意书(注明版本号和日期) | √ | √ | |
5 | 本中心研究者履历FJ-SOP-003-06,附执业资格证书、职称证书、GCP证书副本 | √ | √ | |
6 | 本中心研究者签署的研究人员利益冲突声明FJ-SOP-004-06 | √ | √ | |
7 | 申办者资质(营业执照、GMP证书或满足GMP条件声明,委托生产的附委托书和被委托方GMP文件)、申办者委托本机构开展临床试验的委托书 | √ | √ | |
8 | 药品监督管理部门对试验方案的许可或备案文件 | √ | 如有 | |
9 | 组长单位伦理批件及伦理委员会成员表(如本中心为参加单位) | √ | √ | |
10 | 试验用药品检验报告 | √ | √ | |
11 | 病例报告表或EDC样表(注明版本号和日期) | √ | √ | |
12 | 监查员派遣函/授权书、GCP证书、身份证副本 | √ | √ | |
13 | 除知情同意书外,其他提供给受试者的资料(如受试者宣教材料、日志卡、评分表等,注明版本号和日期) | 如有 | 如有 | |
14 | 招募受试者的方式和相关材料(包括发布渠道,注明版本号和日期) | 如有 | 如有 | |
15 | 受试者保险相关文件 | 如有 | 如有 | |
16 | CRO相关资质证明及申办方对CRO的委托函 | 如有 | 如有 | |
17 | 中心实验室或第三方实验室资质及室间质评证书 | 如有 | 如有 | |
18 | 盲法试验的揭盲程序和文件(如试验设置盲法,但未在试验方案中提及) | 如有 | 如有 | |
19 | 安慰剂对照说明(如使用安慰剂对照) | 如有 | 如有 | |
20 | 研究病历样表(如试验采用研究病历,且本中心拟采用,注明版本号和日期) | 如有 | 如有 | |
21 | 申办者和CRO提供的其他文件 | 如有 | 如有 |
5.申请器械临床试验需要提交的资料(见下表)
序号 | 资料名称 | 注册类 | 非注册类 |
1 | 临床试验申请表FJ-SOP-002-05 | √ | √ |
2 | 研究者手册(注明版本号和日期) | √ | √ |
3 | 试验方案(注明版本号和日期,申办方盖章、本中心研究者签名) | √ | √ |
4 | 知情同意书(注明版本号和日期) | √ | √ |
5 | 本中心研究者履历FJ-SOP-003-05,附执业资格证书、职称证书、GCP证书副本 | √ | √ |
6 | 本中心研究者签署的研究人员利益冲突声明FJ-SOP-004-05 | √ | √ |
7 | 申办者资质(营业执照、生产许可等)、申办者委托本机构开展临床试验的委托书 | √ | √ |
8 | 药品监督管理部门对试验方案的许可或备案文件 | 如有 | 如有 |
9 | 组长单位伦理批件及伦理委员会成员表(如本中心为参加单位) | √ | √ |
10 | 试验用医疗器械自检报告和产品注册检验报告,试验用/对照组医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明 | √ | √ |
11 | 病例报告表或EDC样表(注明版本号和日期) | √ | √ |
| 12 | 监查员派遣函/授权书、GCP证书、身份证副本 | √ | √ |
13 | 除知情同意书外,其他提供给受试者的资料(如受试者宣教材料、日志卡、评分表等,注明版本号和日期) | 如有 | 如有 |
14 | 招募受试者的方式和相关材料(包括发布渠道,注明版本号和日期) | 如有 | 如有 |
15 | 受试者保险相关文件 | 如有 | 如有 |
16 | CRO相关资质证明及申办方对CRO的委托函 | 如有 | 如有 |
17 | 中心实验室或第三方实验室资质及室间质评证书 | 如有 | 如有 |
18 | 盲法试验的揭盲程序和文件(如试验设置盲法,但未在试验方案中提及) | 如有 | 如有 |
19 | 研究病历样表(如试验采用研究病历,且本中心拟采用,注明版本号和日期) | 如有 | 如有 |
20 | 申办者和CRO提供的其他文件 | 如有 | 如有 |
6.上述材料需提交一份纸质文档,申办方盖章处不宜用其他单位盖章代替。用文件夹或文件盒装订,推荐使用文件盒,标签标注项目名称。
7.项目受理后,可同期进行立项材料准备、合同谈判、伦理审查。推荐使用本中心临床试验协议模板(见附件),但不做强制要求。合同草稿经机构办审核后,由机构办上传至医院合同审核系统,供各职能科室和院领导审核。审核全部通过后,机构办导出pdf版(带水印)给申办方签署,后交机构签署。合同签署时根据监管部门的要求,应同期签署CRC协议、廉洁协议(见附件,廉洁协议签署方与主合同签署方保持一致)。
8.项目启动的必要条件:立项材料齐全、获得伦理批件、各方已签署合同、首笔款到位(合同另有约定除外)、试验用药品/器械/相关物资已到位。
附件
(药物临床试验使用表格:06版)
(器械临床试验使用表格:05版)